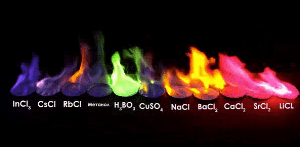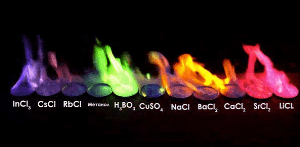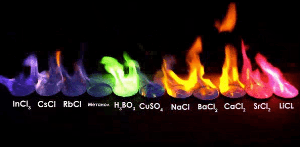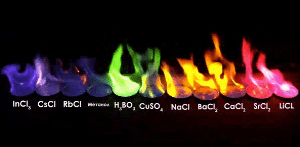이전 단원에서 우리는 지각에서 여러 가지 광물들이 생성된다는 것을 배웠습니다. 채취된 광물을 가공하여 원자를 얻어낼 수 있습니다. 원자는 너무 작아서 눈에 보이지 않지만 불꽃반응이나 선스팩트럼 분석으로 구분해 낼 수 있습니다.
이렇게 분류된 원소는 발견된 광물 이름, 광산, 특징, 색 등에 의해서 이름 지어졌습니다. 현재는 IUPAC(아이유팩, 국제화학협회)에서 이름과 기호의 등록을 관리하고 있습니다.
이 원소들은 자연계에서 존재 할 때, 홀로 존재하지 않고, 분자를 이루어 전기적 중성을 띕니다. 이 분자들은 물에 녹였을 때, 앙금(sediment)으로 남기도 하지만, 물에 녹아 이온으로 분리되기도 합니다. 이렇게 만들어진 용액들끼리 섞였을 때, 결합력이 강한 이온들이 만나면 침전물이 생기기도 합니다.
우리는 이전 단원에서 미시의 세계를 설명하기 위해 입자 모형을 배웠었습니다. 원자, 분자, 이온을 설명하기 위해 원자핵-전자 모형이 제시되었습니다.
주요 실험: *불꽃 반응 실험, *선스팩트럼 관찰, *질산은 침전물 실험
불꽃 실험
중1: 지각의 구성 단원에서 우리는 지각에 다양한 광물들이 존재한다는 것을 배웠습니다. 대부분의 시료는 순수하게 얻을 수 없고, 퇴적광물을 분쇄와 재 결정화 작업을 반복하여 순도 높은 시료를 구할 수 있습니다. 불꽃실험에서 사용되는 다음 시료들은 아래와 같은 광산에서 채굴됩니다.
| 시료명 | 광물명 | 종류 | 분포 |
|---|---|---|---|
| 염화 소듐 | 암염 (halite) |
퇴적암 | 볼리비아(Salar de Uyuni, 우유강), 오스트리아(Salzkammergut), 칠레(Salar de Atacama), 볼리비아(Salar de Caracoles) |
| 질산 소듐 | 칠레 초석 | 퇴적암 | 칠레, 페루 사막지역(Atacama Desert, Andes Mountains, Kalama, Iquique) (Chile saltpeter, sodium nitrate, soda niter) |
| 염화 포타슘 | 포타슘 염 (Potassium salt) |
주로 퇴적암 | 캐나다(Saskatchewan), 러시아(Novocheboksarsk, Minsk), 벨라루스(Soligorsk, Gomel), 독일(Duisburg), 중국(최대) |
| 질산 포타슘 | |||
| 염화 스트론튬 | 스트론티안염 (Strontianite) |
변성암 | 스코트랜드(Strontian, 최초), 미국(Strontian, Ohio), 맥시코(Aguascalientes), 폴란드(Scorz) |
| 질산 스트론튬 | |||
| 염화 리튬 | 엽장석, 리튬염 (Lithium salt) |
주로 퇴적암 | 엽장석(브라질, 최초), 체코(Sedlčany, 최장), 러시아, 그린란드, 중국(티벳, 쓰촨), 호주(Greenbushes, 최대), 칠레(Salar de Atacama, 호수), 아르헨티나(아르헨티나) |
| 질산 리튬 | |||
| 염화 구리 | 주로 황화구리 (Chalcopyrite) |
주로 퇴적암 | 칠레(Antofagasta, 최대), 중국(쿤란다 지역), 페루, 미국, 호주(Greenbushes, Kalgoorlie), 캐나다(Saskatchewan, British Columbia), 잠비아 |
상기 시료들은 금속과 비금속이 합성된 형태로 존재합니다. 예를 들어, 염화소듐은 염소(비금속) + 소듐(금속)의 화합물입니다. 모든 시료가 모두 풍부한 것은 아닙니다.
/2차 수정: 2024, @iseohyun.com
불꽃 반응은 시료가 어떤 성분으로 이루어져 있는지 알 수 있는 방법입니다.
적은양으로 판별이 가능하다는 장점을 가지고 있습니다.
주로 금속원소가 불꽃과 반응시켜 불꽃의 색을 확인하는 방법으로,
예를 들어, 실험에서 '염화○○'와 '질산○○'은 언제나 같은 불꽃 색이 관찰됩니다.
따라서 불꽃색은 ○○에의해 결정된다는 것을 알 수 있습니다.
같은 이유로 불꽃놀이의 색을 보고 어떤 화약을 사용했는지 알 수 있습니다.
| 시료명 | 화학식 | 시료명 | 화학식 | 시료명 | 화학식 | 시료명 | 화학식 | |
|---|---|---|---|---|---|---|---|---|
| 시료명 | 염화 소듐 | NaCl | 염화 포타슘 | KCl | 염화 스트론튬 | SrCl2 | 염화 구리 | CuCl2 |
| 질산 소듐 | NaNO3 | 질산 포타슘 | KNO3 | 질산 스트론튬 | Sr(NO3)2 | 질산 구리 | Cu(NO3)2 | |
| 불꽃 색 | 노란 색 | 보라 색 | 붉은 색 | 녹 색 | ||||
| 원소명 | 기호 | 불꽃색 |
|---|---|---|
| 리튬 | Li | 붉은색 (핑키) |
| 스트론튬 | St | 붉은색 (쌔빨간) |
| 칼슘 | Ca | 주황색 |
| 소듐(나트륨) | Na | 노랑색 |
| 구리 | Cu | 파란색(에메랄드색) 교과: 청록색 |
| 바륨 | Ba | 녹색(풀색) 교과: 황록색 |
| 루비듐 | Rb | 보라 |
| 세슘 | Cs | 청색(연보라) |
| 포타슘(칼륨) | K | 보라색 |
| 알루미늄 | Al | 은색 |
이 시료(화합물)는 화학적으로 둘 이상으로 쪼갤 수 있습니다. 원소는 화학적으로 자를 수 있는 최소한의 단위입니다. 리튬은 원소이고, 리튬 하고 화합된 염화 리튬은 분자라고 합니다. 이러한 불꽃색을 관찰하는 사람마다 정성적인 평가로 인해 정확한 판단이 어려울 것 같지만, 불꽃에서 발생하는 빛을 스펙트럼 분석하면, 그 원소가 방출하는 정확한 색을 알 수 있습니다.
-
원소(element) : 화학적으로 분리할 수 있는 가장 작은 단위
*물리적으로 더 작게, 양성자, 중성자, 쿼크로 분리가 가능 - 원자(atom) : 원소 입자
아래 스펙트럼은 수소가 연소하면서 발광한 빛을 굴절의 원리(중1: 빛과 파동)를 이용하여 분광한 결과입니다.
 요한 발머가 관측한 수소 스펙트럼(1885)
"Emission_spectrum-H.png", Merikanto, wikimedia.org, public domain
요한 발머가 관측한 수소 스펙트럼(1885)
"Emission_spectrum-H.png", Merikanto, wikimedia.org, public domain
스펙트럼 분석을 통해서 무언가 공통되지만 확실히 구분 지을 수 있는 물질이 있다는 확신을 하게 됩니다.
원소
불꽃반응 스펙트럼에서는 금속원소만 색으로 구분을 했지만, 모든 물질이 원소로 이루어져 있습니다. 일찍이 선사시대부터 사용해 왔던 원소부터 최근에 발견, 인공 생성한 원소까지 총 118개의 원소가 등록되어 있습니다. [표. 원소의 발견]은 잘 알려진 원소와 그 발견된 시기 및 이름의 유래를 정리한 것입니다.
[표. 원소의 발견]을 정리하면서 정보를 전달함에 있어서 고민이 있었습니다. 하나의 원소에서도 발견된 시기, 정제된 시기, 원소로 인식한 시기 (또는 원소가 존재할 것이라고 예측한 시기), 명명이 된 시기가 다 다르기 때문이었습니다. 각각의 업적이 어느 것 하나 사소하다고 할 수 없었지만, 모든 정보를 포함할 수 없기에, 일부를 누락하더라도 최대한 정보의 왜곡 없이 작성하려고 노력하였습니다. 정렬은 최초 분리시기를 기준으로 하되 분리가 필요 없이 자연존재하는 원소의 경우 최초 발견시기를 기준으로 하였습니다.| 원소 번호 | 원소명 (영문) |
기호 | 최초 분리(국적) |
연도 | 기원 | 상세 |
|---|---|---|---|---|---|---|
| 1 | 수소 (Hydrogen) |
H | Antoine Lavoisier (앙투앙 라부아지에, 프랑스) |
1787 | 물질특성 | hydro(물) + gen(만들다) : 수소는 물을 만드는 물질 |
| 2 | 헬륨 (Helium) |
He | He Ramsay, Rayleigh (렘지, 레일리, 영국) |
1895 | 관련 신화 | helios(헬리오스, 로마 태양신), 태양 관측중 발견 : 태양을 이루는 물질 |
| 3 | 리튬 (Lithium) |
Li | William Thomas Brande (윌리엄 토마스 브랜드, 영국) |
1821 | 발견된 광석명 | íthos(그리스어, 돌) 스웨덴 광산으로부터 |
| 4 | 베릴륨 (Beryllium) |
Be | Wöhler (프리드리히 뵐러, 독일) |
1828 | 발견된 광석명 | beryllus(에메랄드(녹주석)색, 라틴어) : 실제 에메랄드는 크롬 또는 벤듐 |
| 5 | 붕소 (Boron) |
B | Humphry Davy (험프리 데이비, 영국) |
1808 | 물질특성 | borex(붕사, 하얗다(būraq, 아랍어)) 광산, 염호에서 추출 |
| 6 | 탄소 (Carbon) |
C | 고대 이집트로부터 | -3750 | 발견된 광석명 | carbo(석탄, 라틴어) |
| 7 | 질소 (Nitrogen) |
N | Daniel Rutherford(발견) (다니엘 러더퍼드, 스코트랜드) |
1790 | 물질특성 | azotikos(생명이 없음=질식성, 그리스어)->nitrogène (프랑스어) |
| 8 | 산소 (Oxygen) |
O | Michael Sendivogius(발견) (마이클 샌디보기우스, 폴린드) |
1604 | 물질특성 | oxys("날카로운", 산의 맛(그리스)) + genēs(생산자, 그리스) : 산을 만드는(불타는) 물질 |
| 9 | 플루오린 (Fluorine) |
F | Henri Moissan (헨리 무아상, 프랑스) |
1886 | 발견된 광석명 | floēs (형광, 라틴어) + ine(음성 물질) : fluorite(형석, 형광색 광물) |
| 10 | 네온 (Neon) |
Ne | Ramsay, Rayleigh (렘지, 레일리, 영국) |
1898 | 발견된 환경 | novum(새로운, 라틴어) -> neon(그리스어) |
| 11 | 소듐(나트륨) (Sodium) |
Na | Humphry Davy (험프리 데이비, 영국) |
1807 | 사용특성 | natron(씻다, 라틴어, 이집트):베르셀리우스 원소기호법 suda(두통, 아랍어) 두통제: IUPAC 원소명명법 |
| 12 | 마그네슘 (Magnesium) |
Mg | Humphry Davy (험프리 데이비, 영국) |
1808 | 발견된 지역명 | magnesia(지역명, 그리스어), 백색 돌 -> 마그네슘 |
| 13 | 알루미늄 (Aluminium) |
Al | Hans Christian Ørsted(발견) (외르스테르, 덴마크) |
1824 | 물질특성 | alumen(쓴, 라틴어), 알칼리 = 쓴 맛 |
| 14 | 규소 (Silicon) |
Si | Jöns Jacob Berzelius (베르셀리우스, 스웨덴) |
1823 | 발견된 광석명 | silex(부싯돌, 라틴어), 부싯돌:석영(SiO2,이산화규소가 주광물인 돌) |
| 15 | 인 (Phosphorus) |
P | Hennig Brand(발견) (헤니그 브랜드, 독일) |
1669 | 관련신화 | phōsphoros(빛을 가져오는자, 그리스신화, 금성(해가 뜨기 전에 뜨는 별)), 인의 강한 폭발성 |
| 16 | 황 (Sulfur) |
S | 고대시대로 추정 (-3500 ~ 500) |
-2000 | 물질특성 | Sulvere (불을 키다, 라틴어), 불이 잘 붙음 |
| 17 | 염소 (Chlorine) |
Cl | Carl Wilhelm Scheele (빌헬름 셀레, 스웨덴) |
1774 | 물질특성 | chlōros(녹황색, 그리스어), 염소 기체의 색 |
| 18 | 아르곤 (Argon) |
Ar | Ramsay, Rayleigh (렘지, 레일리, 영국) |
1894 | 물질특성 | argon(게으른, 그리스어), 반응성이 낮음 |
| 19 | 포타슘(칼륨) (Potassium) |
K | Humphry Davy (험프리 데이비, 영국) |
1807 | 출처오해 | potash(pott냄비+aschen잿물), kali(어근 alkaly(식물의 재, 아랍어), 칼륨염을 추출하는 초기 방법 |
| 20 | 칼슘 (Calcium) |
Ca | Humphry Davy (험프리 데이비, 영국) |
1808 | 발견된 광석명 | calx (석회, 라틴어) |
| 25 | 망가니즈 (Manganese) |
Mn | Johan Gottlieb Gahn (요한 고틀립 간, 스웨덴) |
1774 | 발견된 지역명 | magnesia(지역명, 그리스어), 흑색 돌: Mangan(망간, 독일어), 그리스어가 학술적통일성이 있다고 판단 |
| 26 | 철 (Iron) |
Fe | 철기부터 사용 됨 | -1180 | 발견된 광석명 | ferrum(철, 라틴어) |
| 28 | 니켈 (Nickel) |
Ni | Axel Fredrik Cronstedt (크론스테트, 스웨덴) |
1751 | 관련 신화 | nickel(장난꾸러기 요정, 독일신화) 중세독일 구리광산에서 구리가 추출되지 않자 |
| 29 | 구리 (Copper) |
Cu | 석기시대 이후부터 사용 됨 | -9000 | 발견된 지역명 | cyprium(키프레스, 로마어) 구리가 많이 채굴된 공화국 |
| 30 | 아연 (Zinc) |
Zn | Andreas Sigismund Marggraf (마르그라프, 독일) |
1746 | 물질특성 | zinke(뾰족한, 들쭉날쭉한, 독일어)>금속 아연 모양 결정, seng(돌, 페르시아어) |
| 33 | 비소 (Arsenic) |
As | 아랍시기부터 사용 됨 | 815 | 물질특성 | the orpiment(노란색, 아랍어) ->arsenicum(라틴어)-> arsenic(프랑스어) |
| 47 | 은 (Silver) |
Ag | 선사시대 이후로 추정 | -5000 | 물질특성 | argentum(은, 라틴어) -> 흰색, 빛나는(인도)의 영향, silver는 silubra(게르만조어) 파생 |
| 50 | 주석 (Tin) |
Sn | 청동기 초기 | -3000 | 잘 모름 | stannum(주석, 라틴어) 기원은 알려지지 않음. Tin은 tin-om(게르만조어)파생 |
| 53 | 아이오딘 (Iodine) |
I | Bernard Courtois (베르나르 쿠루투아, 프랑스) |
1811 | 물질특성 | Iodine(보라색, 고대 그리스어)> 분해과정에서 과도한 황산 첨가, 보라색 증기 구름/ Jod(요어드, 독어) |
| 78 | 백금 (Platinum) |
Pt | Antonio de Ulloa(발견) (안토니오 드 울로아, 스페인) |
1735 | 물질특성 | platina(작은 은백색의 (불순물)금속, 스페인어) |
| 79 | 금 (Gold) |
Au | 선사시대 이후로 추정 | -6000 | 물질특성 | Aurora(빛나는 새벽, 인도유럽조어) > aurum(금, 라틴어)/ gulba(빛나다, 노란색, 게르만어) *백금(Platinum)과 백금(White Gold, 합금, 싸다)는 다르다. |
| 80 | 수은 (Mercury) |
Hg | 대략 고대이집트시기 | -1500 | 물질특성 | hydrargyrum(수은, 고대 그리스) = hydro(물) + argyrum(은) |
원소는 발견된 위치나 광물과 관련하여 라틴어를 기준으로 기호를 만듭니다. 다만, 그 명칭은 기존에 사용하던 명칭을 그대로 사용하는 편입니다. 현대에 들어서 발견한 원소들은 국제표준(IUPAC)에 의거하여 이름을 정합니다.
-
발견 인정
* 실험실에서 재현 가능한 방법으로 10-14초 동안 유지되어야 발견한 것으로 인정 - 발견자 제안
-
전문가 검토(일관성, 번역용이성(영문) 등)
* 일관성 예 : -ium(금속류), -n(비금속류) - 추천안 공고(5개월)
- 공식 승인
 주기율표
"500px-Simple_Periodic_Table_Chart-en.svg", Offnfopt, wikimedia.org, public domain
주기율표
"500px-Simple_Periodic_Table_Chart-en.svg", Offnfopt, wikimedia.org, public domain
주기율표의 가장 최근의 정보는 IUPAC홈페이지에서 확인할 수 있습니다.
분자
원소를 찾아내는 과정에서 작은 알갱이(입자: 중1: 기체의 성질)들은 어떻게 결합해 있는 걸까요? 원자들이 모여 하나의 입자로 이루어진 형태를 분자라고 합니다.
- 분자(molecule) : 한 개 이상의 비금속 원자가 화학결합에 의해 전기적으로 '중성'을 띠는 원자 그룹. 고유한 성질을 가지는 가장 작은 단위 입자.
분자는 특별합니다. 수소와 산소는 모두 폭발성이 강하지만, 수소 2개와 산소 1개가 결합한 물은 불을 끄는데도 사용됩니다. 과학자들은 원자들이 무작위로 결합하는 것이 아니고, 어떠한 결합법칙을 갖고 분자들이 결합한다는 것을 찾아냈습니다. 분자모형은 원자들의 결합된 모양을 보여줍니다. 분광실험에서도 보았듯이 특정원소가 특정 색을 발광하지는 않지만 시뮬레이션 또는 모형에서 자주 표현되는 색이 있습니다.
| 기호 | 원소 | 색 | 유래 |
|---|---|---|---|
| C | 탄소 | 검은색 | 숯 |
| H | 수소 | 흰색 | |
| N | 질소 | 파란색 | 공기78%, 하늘 |
| O | 산소 | 적색 | 연소 |
| F | 플루오린 | 노란색 | 액체색 |
| Cl | 염소 | 초록색 | 기체색 |
| Br | 브롬 | 갈색 | 액체색 |
| I | 요오드 | 보라색 | 기체색 |
| 분자명 | 분자식 | 분자 모형 |
|---|---|---|
| 산소 | O2 | |
| 물 | H2O | |
| 염화수소 | HCl | |
| 이산화탄소 | CO2 | |
| 일산화탄소 | CO | |
| 암모니아 | NH3 | |
| 메테인 (메탄) |
CH4 | |
| 프로판 (옥탄가 3) |
C3H8 | |
| 휘발유 (옥탄가 4~9) |
CnH2n+2 (n = 4~9) |
|
| 벤젠 | C6H12 | |
| 포도당 | C6H12O6 |
분자명과 분자모델
- 분자명은 분자가 포함된 이름으로 부른다.(염화+수소, 2-산화-탄소, 1-산화-탄소...)
- 이미 이름을 가지고 있는 경우 그대로 부른다.(물, 암모니아, 메테인...)
- 모형: 결합은 -로 연결한다. (= 이중결합, ≡ 삼중결합)
- 모형: 결합각을 표현할 수 있다. (물 vs 이산화탄소)
- 모형: 결합각을 표현할 수 있다(2). (암모니아 - 두꺼운 선, 점선)
- 모형: 수소는 생략할 수도 있다. (프로판, 휘발유, 벤젠...)
- 모형: 탄소는 글자만 생략한다. (프로판, 휘발유, 벤젠, 포도당...)
자연계에서 원자들이 어떠한 결합법칙에 의해서 분자가 되었다는 것을 알았습니다. 그런데, 어떻게 원자들이 분자들로 뭉쳐져 있었을까요?
전하
 전기를 모으는 실험(라이덴 병)
"500px-Andreas_Cunaeus_discovering_the_Leyden_jar.png", Chetvorno, wikimedia.org, public
domain
전기를 모으는 실험(라이덴 병)
"500px-Andreas_Cunaeus_discovering_the_Leyden_jar.png", Chetvorno, wikimedia.org, public
domain
전하(electronic charge)란 물체가 띄고 있는 정전기의 양입니다. 원소 발견 과정은 전기와 연관이 많았습니다. 특히 물에 녹인 물질이 전기에 의해서 양극단에 몰려가는 모습은 물질이 전기에 의해 이끌린다고 생각하는 것이 합리적이었습니다. 또한 모든 물질을 마찰했을 때, 그 크기는 다를지언정 전기가 생성된다는 사실은 모든 물질이 전기와 관련된 물질을 가지고 있다고 보아야 했습니다. 이것이 바로 원자핵(양성자)-전자 모델입니다. 원자핵-전자 모델에서, 원자핵을 기준(+)으로 잡고, 그 주위에 전하의 평형을 이뤄줄 물질을 전하(-)라고 이름 붙였습니다. 원자 전자 모델은 다음 현상을 완벽히 설명했습니다.
- 원소들이 각각 자성을 띄기 때문에 서로 다른 원소가 서로 뭉쳐있을 수 있습니다.
- 모든 물체가 마구잡이로 결합하는 것이 아니고, 극성이 중성이 되는 만큼 결합한다고 하면 모든 결합이 설명이 됩니다.
- 물체의 극성은 원소의 질량과 관계가 높았으므로 핵이+, 전자가- 라면 전자가 쉬이 이탈하지 않는 현상과, 특정조건에서 전자가 이탈하는 현상 모두 설명이 됩니다.
- 모든 물체가 전자를 가지고 있다면, 모든 물체에서 정전기가 일어나는 현상을 설명할 수 있습니다.
 러더퍼드 금박 산란실험
"220px-Rutherford_Scattering", Fujnky, wikipedia.org, public domain
러더퍼드 금박 산란실험
"220px-Rutherford_Scattering", Fujnky, wikipedia.org, public domain
최초의 원자핵-전자 모델은 거대한 푸딩에 전자들이 박혀있는 구조를 상상했습니다(톰슨). 이 구조는 다음 2가지를 설명하지 못했습니다.
- 러더퍼드 금박 산란실험: 전자가 물질을 쉽게 통과하는 이유가 뭐지? (핵의 크기가 생각보다 작다)
- 특정 원소가 특정 불꽃색을 나타내는 이유가 뭐지? (에너지 준위를 갖는 괘도가 있다)
- 양성자가 서로 밀어내지 않는 이유는? (중성자가 있다)
- 설명이 어려운 추가 스펙트럼의 등장! (전자궤도가 확률에 의해 존재한다.)
원자핵-전자 모델은 물질의 전기적 성질을 아주 잘 설명하기 때문에 지금까지 사용되고 있습니다. 최초의 주장은 전자는 원자 주위 어딘가에 있을 것이라고 추정했습니다.
물에 녹이는 행위도 어떤 의미로 전기분해에 해당합니다. 물 분자는 결합된 모양(H20의 결합각; 전기쌍극자)으로 인해서 기본적으로 극성을 가지고 있습니다. 용질의 결합이 충분히 강하지 않고, 용매의 크기에 적절할 때, 용질은 비교적 안정한 상태(옥탯규칙)을 만족하는 형태로 분리되어 해리되게 됩니다. 이때, 용매에 전기를 가하면 각각의 방향으로 끌려서 분리가 되기 시작합니다. 1821년 영국의 윌리엄 토머스 브랜드가 산화리튬을 전기분해하여 리튬을 추출해 내었습니다.
- 용액(Solution) : 두 물질이 균질하게 혼합되어 있는 상태 (예: 소금물)
- 용매(Solvent) : 녹이는 역할을 하는 물질(예: 물)
- 용질(Solute) : 녹는 물질(예: 소금)
이온은 원자 상태일수도 있고, 분자상태일 수도 있습니다. 원소가 안정성을 찾으려는 힘(원리)에 따라서 원소의 이온의 형태는 정해져 있습니다.
| 양이온 | 음이온 | 결합 | 이름 |
|---|---|---|---|
| Na+ | Cl- | NaCl | 염화나트륨(소금) |
| Ca2+ | O2- | CaO | 산화칼슘(석회) |
| Mg2+ | CO32- | MgCO3 | 탄산마그네슘(마그네사이트, 광물) |
| NH4+ | NO3- | NO3NH4 | 질산암모늄(비료, 화약, 냉각제) |
이온은 특정한 상황에서 다른 이온과 반응하여 앙금이 생성될 수 있습니다. 이온상태로 존재하다가 더 강한 결합을 만나면 입자를 이루어 침전물이 되기도 합니다. 즉, 투명해 보이는 물이라도 특정 수용액과의 반응을 통하여 어떤 수용액이었는지 유추할 수 있습니다.
- 물에 녹아 이온화 되는 현상을 확인한다.
- 이온이 결합하여 앙금이 생성되는 경우가 있음을 확인한다.
| NaCl | CaCl2 | NaNO3 | Ca(NO3)2 | |
|---|---|---|---|---|
| AgNO3 | AgCl | AgCl | - | - |
| Na2CO3 | - | Ca2CO3 | - | Ca2CO3 |
| AgCl | Ca2CO3 | PbI2 |
|---|---|---|
| 흰색 | 흰색 | 노란색 |
질산은(AgNO3)과, 탄산나트륨(Na2CO3)에 모두 앙금이 생겼다면, 최초 수용액이 염화칼슘(CaCl2)였음을 유추할 수 있습니다. 질산은은 염화이온을 찾아내는데 좋은 효과가 있으므로, 수돗물에 염소이온(Cl-)이 있는지 확인할 수 있습니다. (소독)
- 이온(cation) : 전기를 띈 원자 또는 원자단 (양이온(cation), 음이온(anion))
이야깃거리
-
화학교수님이 운영하는 유튜브 채널:
(3분 화학 기초편) 원소 원자 분자 이해하기 -
자원 발굴: 대한민국 아르헨티나 리튬광산(2023)
지하수에 녹은 리튬이온을 농축하는 염전과 같은 모습입니다. -
수돗물 소독
수돗물 소독 방법은 염소소독법, 오존살균처리법, 자외선살균처리법 등이 있고, 한국은 염소소독법을 채택하고 있습니다.[엠디팩트] 수돗물 냄새 원인은 ‘잔류염소’ … 소독 돕지만 건강 해칠 수도, 현정석, 동아일보, 2015.11.16 -
음이온 제품
음이온이 분사되면, 양이온과 반응하여 중성이 되거나, 기존의 약한 결합을 끊고(파괴하고) 새로운 결합을 만들어 냅니다(수돗물 염소 소독의 예시). 음이온 제품의 주장은 음이온이 분사되면 나쁜 세균들만 죽일 수 있다고 합니다.도널드 트럼프(미국 45대 대통령): 소독제를 주사해서 코로나바이러스를 치료하자. Trump suggests 'injection' of disinfectant to beat coronavirus and 'clean' the lungs, Dartunorro Clark, nbcnews.com, 2020. 4. 24
음이온 제품(2019.7이후 광고 금지, 표시·광고의 공정화에 관한 법률 시행령)은 전기 분해로 인한 방출, 라돈 등의 방사선 배출 제품으로 구분됩니다. 판매자는 판매 중인 제품의 광고 내용에 대한 실증 책임이 있습니다. 단순히 과학 용어가 들어있는 것인지, 실증 내용이 합리적인지 따져보아야 할 것입니다.
단어
| No | 영어 | 국어 | 영어 | 국어 |
|---|---|---|---|---|
| 1 | atom | 원자 | gold | 금 |
| 2 | hydrogen | 수소 | zinc | 아연 |
| 3 | helium | 헬륨 | arsenic | 비소 |
| 4 | lithium | 리튬 | silver | 은 |
| 5 | beryllium | 베릴륨 | tin | 주석 |
| 6 | boron | 붕소 | iodine | 아이오딘 |
| 7 | carbon | 탄소 | platinum | 백금 |
| 8 | nitrogen | 질소 | electron | 전자 |
| 9 | oxygen | 산소 | element | 원소 |
| 10 | fluorine | 플루오린 | molecule | 분자 |
| 11 | neon | 네온 | ion | 이온 |
| 12 | sodium | 소듐(나트륨) | cation | 이온, 양이온 |
| 13 | magnesium | 마그네슘 | anion | 음이온 |
| 14 | aluminium | 알루미늄 | sediment | 앙금, 침전물 |
| 15 | silicon | 규소, 실리콘 | electronic charge | 전하 |
| 16 | phosphorus | 인 | ||
| 17 | sulfur | 황 | ||
| 18 | chlorine | 염소 | ||
| 19 | potassium | 포타슘(칼륨) | ||
| 20 | calcium | 칼슘 | ||
| 21 | manganese | 망가니즈 | ||
| 22 | iron | 철 | ||
| 23 | nickel | 니켈 | ||
| 24 | copper | 구리 | ||
| 25 | mercury | 수은 |
퀴즈
- 는 화학적으로 자를 수 있는 최소한의 단위(개념)입니다.
- 는 화학적으로 자를 수 있는 최소한의 단위 입자(실제)입니다.
- 은 원소를 불꽃에 넣었을 때 나타나는 색입니다.
- 특정 원소는 특정 불꽃 반응 색()을 가집니다. (, )
- 원소의 발견과 관리는 에서 관리합니다.
- 는 1개 이상의 비금속 원자가 화학결합에 의해 전기적 중성을 띠는 원자 그룹입니다.
- 는 물체가 띄고 있는 정전기의 양입니다.
- 정전기는 서로 다른 극끼리 당기는 힘()이 존재합니다. 같은 극끼리는 밀어냅니다().
- - 입자모형에서 은 양전하를, 는 음전하를 띕니다.
- 원자가 를 잃으면 양전하를, 를 얻으면 음전하를 띕니다.
- 전하를 띄는 입자를 이라고 합니다.
- 이온은 결합하여 를 이룹니다.
- 분자는 고유한 성질을 가집니다.
- 어떤 물질은 물에 됩니다.
- 녹이는 물질을 , 녹는 물질을 , 이렇게 혼합된 물질을 이라고 합니다.
- 용액 속에서 이온이 결합하면 이 생기고, (가라앉아 쌓임)됩니다.